ISO 13485 là tiêu chuẩn quốc tế đưa ra các yêu cầu đối với hệ thống quản lý chất lượng (QMS) dành riêng cho ngành thiết bị Y tế (Tiêu chuẩn cho thiết bị y tế). Được xuất bản lần đầu tiên vào năm 1996 và được sửa đổi gần nhất vào năm 2016. Chứng nhận này đảm bảo rằng các nhà sản xuất thiết bị y tế có thể đáp ứng các yêu cầu của khách hàng và quy định về an toàn, hiệu quả và chất lượng. Vậy chi tiết ISO 13485 là gì? Cùng KYODO tìm hiểu qua nội dung sau đây.
1. Tiêu chuẩn ISO 13485 là gì?
Tiêu chuẩn ISO 13485 là tiêu chuẩn quốc tế quy định các yêu cầu về hệ thống quản lý chất lượng dành riêng cho lĩnh vực thiết bị y tế. Dựa trên nền tảng ISO 9001, tiêu chuẩn này được xây dựng để đảm bảo sản phẩm y tế đáp ứng đầy đủ yêu cầu pháp lý và an toàn cho người sử dụng. Đây là tiêu chuẩn cốt lõi mà các doanh nghiệp trong ngành y tế cần áp dụng để kiểm soát rủi ro và nâng cao độ tin cậy của sản phẩm.
Tính đên nay, đã có 3 phiên bản của tiêu chuẩn này được công bố bởi tiêu chuẩn hóa quốc tế ISO
- ISO 13485:1996.
- ISO 13485:2003.
- ISO 13485:2016 – Là phiên bản hiện hành.
Tổ chức chứng nhận ISO là gì?
ISO (International Organization for Standardization) là tổ chức Quốc tế về tiêu chuẩn hóa, được thành lập năm 1947. Là cơ quan thiết lập các tiêu chuẩn mang tính quốc tế, chuyên xây dựng và đưa ra các tiêu chuẩn về công nghiệp, thương mại được áp dụng trên toàn thế giới. Hiện nay có hơn 160 nước là thành viên ISO. Việt nam là thành viên thứ 77 tham gia hệ thống tiêu chuẩn ISO.
Xem thêm: [2025] Tiêu chuẩn phòng sạch ISO 14644-1
2. Các yêu cầu cơ bản cho tổ chức và quản lý hệ thống chất lượng trang thiết bị Y tế theo TCVN 13485
Các tổ chức phải thiết lập và duy trì một hệ thống quản lý chất lượng (management system) phù hợp với các yêu cầu của TCVN 13485. Bao gồm việc kiểm soát tài liệu, quản lý phòng sạch, và thực hiện các quy trình kiểm soát để đảm bảo chất lượng sản phẩm. Hệ thống này phải được chứng nhận bởi một tổ chức độc lập để đảm bảo tuân thủ các quy định quốc tế.
ISO 13485 yêu cầu các tổ chức phải tuân thủ các điều khoản và phụ lục của tiêu chuẩn để đảm bảo rằng sản phẩm của họ an toàn và hiệu quả. Các yêu cầu cụ thể bao gồm việc quản lý tài liệu, kiểm soát sản xuất, và đánh giá rủi ro liên quan đến các thiết bị y tế. Các doanh nghiệp phải đảm bảo rằng mọi khía cạnh của quá trình sản xuất và phát triển sản phẩm đều được kiểm soát chặt chẽ.
Phòng sạch và Kiểm soát môi trường
Một trong những yêu cầu quan trọng của tcvn 13485 là quản lý và kiểm soát phòng sạch. Điều này đặc biệt quan trọng trong ngành công nghiệp thiết bị y tế, nơi mà môi trường sản xuất phải được kiểm soát để tránh bất kỳ ô nhiễm nào có thể ảnh hưởng đến chất lượng sản phẩm. Các tổ chức phải thiết lập các quy trình làm sạch và bảo trì phòng sạch để đảm bảo môi trường sản xuất luôn trong tình trạng tốt nhất.
Tại Việt Nam, tiêu chuẩn quốc gia tương đương với ISO 13485:2016 là TCVN ISO 13485:2017. Tiêu chuẩn này được ban hành bởi Tổng cục Tiêu chuẩn Đo lường Chất lượng công bố và có hiệu lực từ ngày 01 tháng 07 năm 2018. Các tổ chức đã chứng nhận phiên bản cũ hơn có thời gian 3 năm đến 01/03/2020 để nâng cấp, chuyển đổi.
Tài liệu và quy định theo TCVN 13485:2017
Điều khoản 04: Yêu cầu về hệ thống quản lý chất lượng (QMS): Thiết lập một yêu cầu chung cho một hệ thống quản lý chất lượng, bao gồm tài liệu hệ thống và thông tin về hồ sơ. Yêu cầu cần có: Sổ tay chất lượng; Tài liệu về thiết bị Y tế; Kiểm soát tài liệu; Kiểm soát hồ sơ.
Điều khoản 05: Yêu cầu về trách nhiệm của quản lý, lãnh đạo để thực hiện và duy trì QMS, cần lập kế hoạch và đánh giá liên tục định kỳ để đảm bảo hoạt động của QMS. Bao gồm: Cam kết của lãnh đạo; Chính sách chất lượng; Lấy khách hàng làm trọng tâm; Mục tiêu chất lượng & lập kế hoạch QMS; Trách nhiệm, quyền hạn và thông tin; Xem lại về hệ thống quản lý.
Điều khoản 06: Quản lý nguồn lực của doanh nghiệp: Kiểm soát về mọi mặt về nguồn lực doanh nghiệp bao gồm: Nhân sự; Máy móc thiết bị; Cơ sở hạ tầng; Môi trường làm việc.
Điều khoản 07: Các yêu cầu cụ thể của sản phẩm từ thiết kế cho đến sản xuất các trang thiết bị Y tế, bao gồm: Lập kế hoạch tạo sản phẩm; Lập kế hoạch cho quy trình của tổ chức; Thiết kế và phát triển; Mua hàng; Sản xuất và cung cấp; Kiểm soát thiết bị giám sát và đo lường.
Điều khoản 08: Đưa ra các yêu cầu để đảm bảo doanh nghiệp có thể hiểu rõ vận hành QMS, xử lý vận hành và cải tiến. Bao gồm: Khái quát đo lường, phân tích, cải tiến; Mục tiêu giám sát, đo lường, phân tích để cải tiến; Kiểm soát các sản phẩm không đạt; Phân tích dữ liệu; Cải tiến liên tục.
Download tài liệu đầy đủ TCVN ISO 13485:2017 PDF tại đây.
Một số điều khoản không cần áp dụng vào hệ thống quản lý chất lượng nếu hoạt hộng của tổ chức hoặc tính chất đặc thù của trang thiết bị Y tế không thuộc phạm vi áp dụng.
3. TCVN ISO 13485 với sản phẩm trang thiết bị Y tế
Đạt chứng nhận ISO 13485 giúp tổ chức, doanh nghiệp hoạt động tại Việt Nam xác định các chuẩn đầu vào đầu ra, nâng cao chuyên môn trong lĩnh vực sản xuất Y tế; thu thập dữ liệu và lập kế hoạch đúng cách; Kiểm soát, phân tích và cải tiến hoạt động sản xuất; Hỗ trợ quản lý và đảm bảo chất lượng sản phẩm.
- Vai trò và lợi ích của ISO 13485 với thiết bị Y tê (Medical devices)
Lợi ích của tiêu chuẩn 13485 là gì?
- Thực hiện đúng yêu cầu pháp lý quy định về hoạt động sản xuất trang thiết bị Y tế.
- Áp dụng tiêu chuẩn được quốc tế công nhận.
- Giảm thiểu rủi ro trong hoạt động sản xuất, kinh doanh.
- Nâng cao uy tín và vị trí của doanh nghiệp tổ chức, mở rộng thị trường và tăng tính cạnh tranh của sản phẩm.
- Tạo sự tin cậy cho khách hàng và đối tác về chất lượng và tính an toàn của sản phẩm.
Tiêu chuẩn này không chỉ là một tiêu chuẩn quản lý chất lượng, mà còn là một công cụ quan trọng để đảm bảo rằng các thiết bị y tế được sản xuất và phân phối đáp ứng các yêu cầu nghiêm ngặt về an toàn và hiệu quả. Việc tuân thủ tiêu chuẩn này giúp các doanh nghiệp thiết bị y tế nâng cao uy tín, đảm bảo sự an toàn cho người dùng, và đáp ứng các quy định quốc tế.
Xem thêm: Tiêu chuẩn ISO 14971, quản lý rủi ro thiết bị Y tế
4. Tích hợp yêu cầu và quy trình chứng nhận ISO 13485
Phạm vi, đối tượng áp dụng
ISO 13485:2016 dành cho các tổ chức tham gia thiết kế, sản xuất, lắp đặt và bảo dưỡng thiết bị y tế và các dịch vụ liên quan.
- Tổ chức, doanh nghiệp sản xuất thiết bị y tế
- Tổ chức, doanh nghiệp Phân phối thiết bị y tế
- Nhà nhập khẩu thiết bị y tế
- Nhà cung cấp dịch vụ thiết bị y tế
- Nhà cung cấp dịch vụ vệ sinh và bảo trì thiết bị y tế
- Phạm vi ứng dụng của ISO 13485
Không áp dụng cho:
- Các tổ chức chỉ cung cấp các dịch vụ thiết bị y tế không liên quan đến sản phẩm thiết bị y tế như dịch vụ tư vấn, đào tạo, sửa chữa, bảo dưỡng.
- Các tổ chức chỉ cung cấp các sản phẩm thiết bị y tế được thiết kế và sản xuất bởi các tổ chức khác.
TCVN 13485 cung cấp các hướng dẫn chi tiết về cách tích hợp các yêu cầu của tiêu chuẩn vào hệ thống quản lý chất lượng hiện có. Điều này giúp các tổ chức dễ dàng tích hợp các yêu cầu mới mà không cần phải thay đổi hoàn toàn hệ thống hiện tại. Các tổ chức thành viên của Global Harmonization Task Force (GHTF) cũng công bố các tài liệu hỗ trợ để giúp các doanh nghiệp hiểu rõ hơn về cách tuân thủ tiêu chuẩn này.
Xem thêm: ISO 17025 là gì? Các cơ sở nào cần ứng dụng ISO tiêu chuẩn 17025
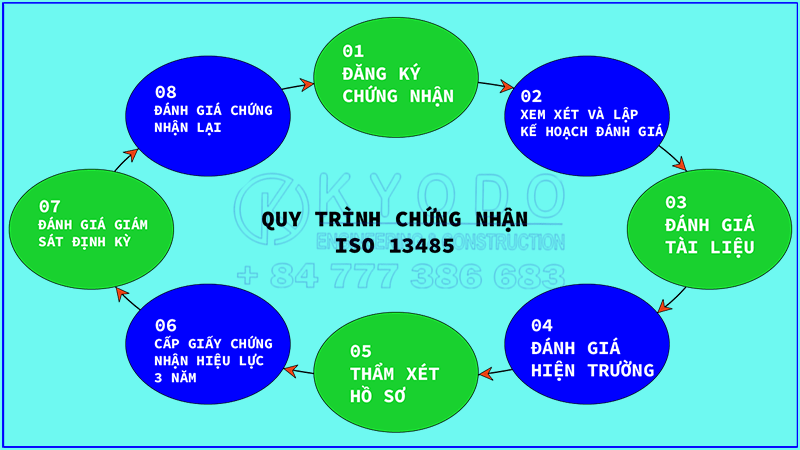
Quy trình đăng ký chứng nhận
Bước 1: Đăng ký chứng nhận
Liên hệ với các tổ chức cấp chứng nhận, và trao đổi chi tiết về các vấn đề liên quan
Bước 2: Xem xét và lập kế hoạch đánh giá
Tổ chức chứng nhận hợp pháp sẽ xem xét và đưa ra các kế hoạch, thủ tục và chi tiết đánh giá để doanh nghiệp nắm rõ như: thời gian, địa điểm, nội dung đánh giá.
- Quy trình chứng nhận ISO 13485
Bước 3: Đánh giá tài liệu
Các tài liệu, hồ sơ về doanh nghiệp và sản phẩm sẽ được tổ chức chứng nhận đánh giá sơ bộ.
Bước 4: Đánh giá hiện trường
Tổ chức chứng nhận đánh giá hiện trường, đánh giá kiểm nghiệm thực tiễn tại cơ sở sản xuất. Xem xét và đào tạo để giúp doanh nghiệp sản xuất đạt sự phù hợp trong hoạt động sản xuất, và phản hồi kết quả.
Bước 5: Thẩm xét hồ sơ
Thời gian thẩm xét hồ sơ và phản hồi kết quả (dự kiến trong vòng 70 ngày).
Bước 6: Cấp giấy chứng nhận
Sau khi đạt được các kết quả đánh giá, tổ chức chứng nhận sẽ cấp giấy chứng nhận ISO 13485 với hiệu lực 3 năm cho công ty, doanh nghiệp.
Bước 7: Đánh giá giám sát định kỳ
Để đảm bảo duy trì được tiêu chuẩn, tổ chức đánh giá chứng nhận và doanh nghiệp sẽ tiến hành đánh giá định kỳ theo các tài liệu ISO 13485, thường là 2 lần trên 1 năm. Thời gian hiệu lực của chứng nhận ISO 13485 là 3 năm, sau khoảng thời gian này, tổ chức cần được đánh giá tổng quan và tiến hành thủ tục tái chứng nhận.
Xem thêm: Tiêu chuẩn ISO 15378 cho sản xuất vật liệu đóng gói bao bì dược phẩm
KYODO thi công các dự án phòng sạch theo chất lượng ISO 13485
KYODO là đơn vị thi công phòng sạch với đa dạng lĩnh vực và ngành nghề sản xuất. Cam kết đáp ứng kiểm định chứng nhận chất lượng. Để tiến hành xây dựng mới hoặc cải tạo cơ sở sản xuất – kinh doanh trang thiết bị y tế phù hợp 13485, hãy liên hệ với chúng tôi để được tư vấn tốt nhất ngay từ khâu thiết kế.